2021年11月5日のニュースで、ファイザー社が新型コロナウイルスの飲み薬タイプの治療薬について、臨床試験の中間結果を米食品医薬品局(FDA)に提出する予定であると報道されました。
お薬の名前は「PAXLOVID™(パキロビッド)」です。プロテアーゼ阻害薬である「 PF-07321332」とHIVの治療薬として承認されている、リトナビルという薬の合剤だそうです。
現在、新型コロナウイルス治療薬で抗ウイルス薬として承認されているものは、すべて点滴の薬であり、飲み薬はありません。
飲み薬になると、新型コロナウイルスの治療が点滴設備が不要となるので、治療方法がおおきく変わる可能性があります。
いずれ日本でも承認申請されると思うので、今回ニュースになった薬について調べてみました。
※2022年2月10日に特例承認を受けて、商品名がパキロビッドとなったため、日本語名称を変更しました。
PAXLOVID™(パキロビッド)ってどんな薬?
パキロビッドは試験薬名「PF-07321332」というプロテアーゼ阻害薬とリトナビルというHIVに使用されている同じくプロテアーゼ阻害薬の合剤です。
厚生労働省の資料に開発中の治療薬として次の記載がありました。
- 成分名:PF-07321332
- 開発企業:ファイザー
- 分類:抗ウイルス薬(プロテアーゼ阻害)
- 開発対象:予防、軽症~中等症Ⅰ(第Ⅲ相)
- 特徴:現在、日本を含む国際共同第Ⅲ相試験を実施中。経口剤。
PF-07321332 の作用機序
「PF-07321332」はまだ仮の名前で、将来的には別の名前がつくと思います。
PF-07321332はパキロビッドの主成分となります。薬の分類としてはプロテアーゼ阻害薬です。
新型コロナウイルスの細胞への侵入と複製の図が「SPring-8で新型コロナウイルスと闘う — SPring-8 Web Site (spring8.or.jp)」にありました。
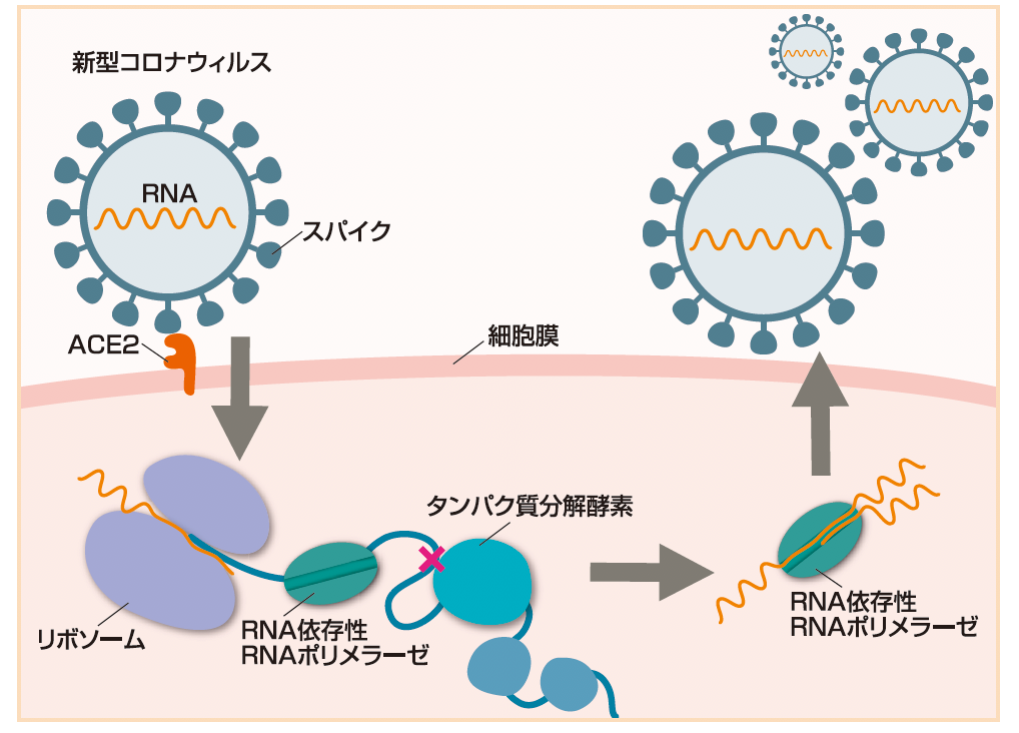
上記図をもとに、コロナウイルスがヒトの体内で増殖する過程を大まかにわけると次の通りです。
- 体内に侵入後、ヒト細胞膜にスパイクタンパクでくっつき、ウイルスRNAが侵入する
- ウイルスRNAをヒト細胞内のタンパク質合成装置(リポソーム)で翻訳し、複数のウイルスタンパク質つながったものが作られる
- 複数の繋がったウイルスタンパク質の中にタンパク質分解酵素(プロテアーゼ)があり、必要な部分に切り分けられる
- 作られたタンパク質のうちRNAポリメラーゼがウイルスRNAを複製し、増殖する
- 増殖したウイルスは細胞外へ放出され、さらに増殖する。
PF-07321332は上記の3の部分のタンパク質分解酵素(プロテアーゼ)を阻害します。新型コロナウイルスのタンパク質分解酵素は「3CLプロテアーゼ」というもので、 PF-07321332 はこの3CLプロテアーゼという酵素を阻害することで、複数の繋がったウイルスタンパク質の切断ができず、結果ウイルスの増殖を防ぐようです。
リトナビルの作用機序
リトナビルは薬というよりは、「リトナビルブースト」という、併用する薬剤の効果の増強を期待して加えられているようです。
リトナビルのWikipediaには次の記載がありました。
リトナビルは、元々はHIVプロテアーゼ阻害薬として開発された。2015年では、抗ウイルス活性を期待して用いることは稀で、他のプロテアーゼ阻害薬の効果増強を目的に併用される。具体的には、リトナビルは患者の肝臓でのCYP3A4によるプロテアーゼ阻害薬代謝を阻害するため、低用量のリトナビルは他のプロテアーゼ阻害薬の効果を増強する。これは1997年に発見されたもので、プロテアーゼ阻害薬およびHAART療法の副作用が大幅に減少した。この効果は他の様々な医薬品の効果にも影響を与えるが、その大きさを正確に予測することは困難である。
リトナビル – Wikipedia 作用機序より
PAXLOVID(パキロビッド)の臨床試験
公表された試験内容と中間解析について紹介します。
紹介元の資料はファイザー公式サイト(英語)のPfizer’s Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk of Hospitalization or Death by 89% in Interim Analysis of Phase 2/3 EPIC-HR Study | Pfizerです。
試験名は「重症化のリスクが高い、入院していない症候性の成人Covid-19患者を対象に、pf-07321332/ritonavirの経口投与をプラセボと比較する、有効性および安全性に関する介入的な第2/3相二重盲検2群比較試験(第2/3相EPIC-HR試験)」で、本試験の目的は、COVID-19に罹患し、入院の必要はないが、重症化のリスクが高い成人の治療に、PF-07321332/リトナビルが安全かつ有効であるかどうかを確認することです。
SARS-CoV-2感染の確定診断を受けた適格な参加者を、PF-07321332/リトナビルまたはプラセボを12時間ごとに5日間(計10回)経口投与する群に無作為に(1:1)割り付けされます。参加者、医療従事者、治験責任者、解析者を含め、実薬かプラセボかわからない設定です。
対象者の基準は次の通りです。
- 無作為化前5日以内にSARS-CoV-2感染が確認された者
- 無作為化実施日前5日以内にCOVID-19徴候・症状が最初に発現し、無作為化実施日に指定されたCOVID-19徴候・症状のうち少なくとも1つが存在すること
- 妊娠可能な被験者は、効果の高い避妊法の使用に同意しなければならない
- COVID-19による重篤な疾患を発症するリスクの増加に関連する特徴または基礎疾患を少なくとも1つ有すること
対象外となる基準は次の通りです。
- COVID-19による治療のために入院したことがある、または入院が必要である。
- 現在の疾患エピソードの前に、SARS-CoV-2感染が確認されていること
- 活動性肝疾患の病歴がある
- 透析を受けているか、または中等度から重度の腎障害があることがわかっている人
- ヒト免疫不全ウイルス(HIV)に感染しており、ウイルス量が400コピー/mLを超えているか、HIV治療のために禁止されている薬を服用していること
- COVID-19以外の活発な全身性感染症の併発が疑われる、または確認されていること
- 試験介入の構成要素に対する過敏症またはその他の禁忌の既往歴
- クリアランスにおいてCYP3A4への依存度が高い、またはCYP3A4の強力な誘導剤である医薬品または物質を現在使用している、または使用が予想されること
- 療養中のCOVID-19血漿を受け取ったことがある、または受け取ることが予想される。
- 34日目までにSARS-CoV-2ワクチンの投与を受けた、または受ける予定のある方
- 長期追跡調査期間中にCOVID-19に関するものを含め、治験薬や治験機器を用いた他の介入型臨床試験に参加していること
- 本試験またはPF-07321332を含む他の試験への参加歴があることが判明していること
- 室温での酸素飽和度が92%未満、または基礎的な肺疾患のために慢性的な補助酸素を定期的に受けている人の場合は、標準的な在宅酸素補給を受けていること
- 妊娠中または授乳中の女性
今回の対象者はCOVID-19に感染したことがなく、コロナワクチンの接種を受けておらず、かつ感染してから5日以内の方が対象となります。
ファイザー社が公表した中間解析結果は次の通りです(Deepl翻訳使用)。
中間データセットの主要解析では、2021年9月29日までに登録された1219名の成人のデータを評価しました。患者の募集停止を決定した時点で、北米、南米、欧州、アフリカ、アジアの臨床試験施設からの登録患者数は、予定していた3,000人の70%に達しており、患者の45%は米国に居住していました。登録された患者は、5日以内にSARS-CoV-2感染が実験室で確認され、軽度から中等度の症状を呈しており、COVID-19による重症化のリスクを高める特徴や基礎疾患を少なくとも1つ持っていることが求められました。各患者は、パキロビッド™またはプラセボを12時間ごとに5日間経口投与するよう無作為に(1:1)割り付けられました。
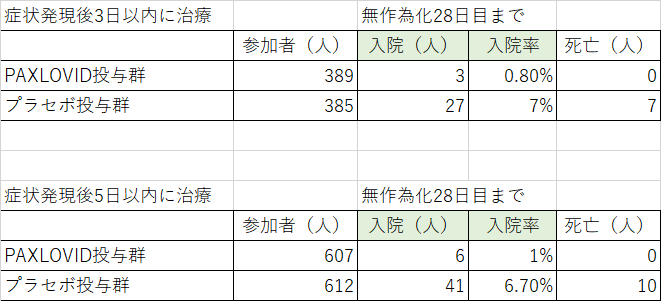
予定されていた中間解析では、症状発現後3日以内に治療を受けた患者において、COVID-19に起因する入院またはあらゆる原因による死亡のリスクが、プラセボと比較して89%減少したことが示されました(主要評価項目)。パキロビッド™を投与された患者のうち、無作為化後28日目までに入院した患者は0.8%(3/389人が入院し、死亡はなし)であったのに対し、プラセボを投与された患者のうち、入院または死亡した患者は7.0%(27/385人が入院し、7人がその後死亡)でした。これらの結果の統計的有意性は高かった(p<0.0001)。COVID-19に関連した入院または死亡は、症状発現後5日以内に治療を受けた患者においても同様の減少が認められました。パキロビッド™の投与を受けた患者のうち、無作為化後28日目までに入院したのは1.0%(入院したのは6/607人、死亡はなし)であったのに対し、プラセボの投与を受けた患者では6.7%(入院したのは41/612人、その後の死亡は10人)であり、高い統計的有意性が認められました(p<0.0001)。28日目までの全試験集団において、パキロビッド™を投与された患者では死亡例がなかったのに対し、プラセボを投与された患者では10例(1.6%)の死亡例が報告されました。
安全性データのレビューには、解析時にデータが入手可能であったEPIC-HRの1881名のより大きなコホートが含まれています。治療開始時の有害事象は、パキロビッド™(19%)とプラセボ(21%)で同等であり、そのほとんどが軽度のものでした。治療上の緊急有害事象について評価可能な患者さんのうち、重篤な有害事象(1.7% vs. 6.6%)および有害事象による試験薬の中止(2.1% vs. 4.1%)は、プラセボと比較してパキロビッド™を投与した患者さんでそれぞれ少なく見られました。
これらの情報から、新型コロナウイルスに感染してから5日以内にパクスロビドを服用することで、入院や重症化、死亡リスクが89%低下しています。また、安全性の詳細データはありませんが、おおきな問題はなさそうです。
現在、上記試験のほかに、2021年8月および9月にそれぞれ開始されたフェーズ2/3 EPIC-SR試験(標準リスク患者におけるCOVID-19のプロテアーゼ阻害作用の評価)およびEPIC-PEP試験(曝露後の予防におけるCOVID-19のプロテアーゼ阻害作用の評価)は、本中間解析には含まれておらず、進行中だそうです。
まとめ
新型コロナウイルスの新しい治療薬であるパキロビッドは、飲み薬で重症化を防ぐという試験成績がでており、期待大です。
また予防投与についても試験が実施されており、濃厚接触者となっても発症せずにすむかもしれません。
日本で承認申請され、特例承認されるようであれば、また追加情報をお知らせできればと思います。



コメント